HUKUM DASAR
KIMIA
I. HUKUM LAVOISIER DAN HUKUM PROUST
· Hukum
Lavoisier adalah hukum kekekalan massa: massa zat sebelum dan sesudah reaksi
adalah sama.
· Hukum
Proust adalah hukum perbandingan tetap: perbandingan massa unsur-unsur dalam
suatu senyawa adalah tetap.
· Contoh
soal:
1.
Perbandingan unsur hidrogen dan oksigen pada pembentukan
air adalah 1 : 8. Tentukan massa gas hidrogen dan massa gas oksigen pada
pembentukan 81 gram air.
Jawab: H2 + O2 à H2O
x
: y mt
1
: 8 81 gram
mH2 =.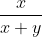 mt mO2
=
mt mO2
=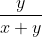 . mt
. mt
mH2 = 9 gram mO2
= 72 gram
2.
Jika 1 gram gas hidrogen direaksikan dengan 10 gram gas
oksigen menghasilkan air. Tentukan massa air yang dihasilkan dan zat yang sisa.
Jawab: H2
+ O2 à H2O
Mula2 1 10
Reaksi 1 8 9
Setimbang 0 2 9
Jadi massa air
yang dihasilkan = 9 gram dan zat yang sisa adalah O2 sebanyak 2
gram.
3.
Perbandingan Fe : S = 7 : 4. Berapa gram besi yang harus
direaksikan dengan 16 gram S agar menghasilkan senyawa FeS?
Jawab: Fe + S à FeS
7 : 4
x : 16
mFe
= x =(7/4) x 16=28 gram
II. HUKUM GAY LUSSAC DAN AVOGADRO
· Hukum Gay
Lussac adalah hukum perbandingan volume: bila diukur pada suhu dan tekanan yang
sama, volume gas-gas yang bereaksi dan hasil reaksi berbanding sebagai bilangan
bulat dan sederhana.
· Hipotesis
Avogadro: pada suhu dan tekanan yang sama, semua gas-gas yang volumenya sama
mengandung jumlah molekul yang sama.
· Contoh
soal:
1.
6 liter gas nitrogen direaksikan dengan gas hidrogen
menghasilkan gas amoniak. Tentukan persamaan reaksi, volume gas hidrogen yang
dibutuhkan, gas amoniak yang dihasilkan.
Jawab: N2 + 3 H2 à 2 NH3
6
18 12
Jadi
volume H2 yang dibutuhkan = 18 liter dan volume NH3 yang
dihasilkan = 12 liter.
2.
Pada pembakaran 50 molekul gas CH4 dengan
oksigen menghasilkan CO2 dan H2O. Tentukan persamaan
reaksi, jumlah molekul gas oksigen yang dibutuhkan, jumlah molekul gas
karbondioksida dan uap air yang dihasilkan.
Jawab: CH4 + 2 O2 à CO2
+ 2 H2O
50 100 50 100
Jadi
jumlah molekul O2 yang dibutuhkan = 100 molekul, jumlah molekul CO2
yang dihasilkan = 50 molekul, dan jumlah molekul H2O yang dihasilkan
= 100 molekul.
3.
Jika 50 ml gas CxHy dibakar dengan 250 ml gas oksigen,
dihasilkan 150 ml karbon dioksida dan sejumlah uap air. Semua gas diukur pada
suhu dan tekanan yang sama. Tentukan rumus molekul CxHy.
Jawab: CxHy + O2 à CO2
+ H2O
50 250 150 z
C à 50x = 150 à x = 3
O à 2.250 = 2.150 + z à z = 500 – 300 = 200
H à 50y = 2z à 50y = 2.200 à y = 400 / 50 = 8
Jadi
rumus molekul C3H8
4.
5 liter campuran CH4 dan C2H6 dibakar
menghasilkan CO2 dan H2O. Jika campuran itu mengandung
20% CH4 dan 80% C2H6, tentukan:
a.
volume gas oksigen yang diperlukan
b.
volume CO2 yang dihasilkan
Jawab: VCH4 = 0,2 . 5 liter =
1 liter VC2H6
= 0,8 . 5 liter = 4 liter
CH4 + 2 O2 à CO2 + 2 H2O
1 2 1 2
2 C2H6 + 7 O2 à 4 CO2
+ 6 H2O
4 14 8 12
a.
Vol. O2 = 2 + 14 = 16 liter
b.
Vol. CO2 = 1 + 8 = 9 liter
5.
Diketahui 6 liter campuran CH4 dan C3H8
dibakar sempurna dengan 18 liter gas oksigen. Jika semua gas diukur pada P dan
T yang sama. Tentukan volum CH4 dan C3H8.
(misal: Vol. CH4 = x à Vol. C3H8 = 6 – x)
Jawab: CH4 + 2 O2 à CO2
+ 2 H2O
x 2x
x 2x
C3H8
+ 5 O2 à 3 CO2 + 4 H2O
6 – x 5(6
– x) 3(6 – x) 4(6 – x)
Vol. O2 = 2x + 5(6 –
x) à18 = 2x + 30 – 5x à18 = 30 –
3x àx = 4
Jadi Vol. CH4 = x = 4 liter
Vol. C3H8 = 6 – x = 6 –
4 = 2 liter
III. HUKUM DALTON
“Jika dua jenis
unsur bergabung membentuk lebih dari satu senyawa dan jika massa-massa salah
satu unsur dalam senyawa-senyawa tersebut sama, sedangkan massa-massa unsur
lainnya berbeda, maka perbandingan massa unsur lainnya dalam senyawa-senyawa
tersebut merupakan bilangan bulat dan sederhana.”






0 komentar:
Posting Komentar